[생명과학과] 박대찬 교수 아주대·서울대 공동으로, 암·퇴행성 질환 치료에 새 희망 제시
- 김대희
- 2022-07-28
- 918

아주대·서울대 공동 연구팀이 암·퇴행성 질환을 치료하고 노화를 억제할 수 있는 세포 자가 포식 작용(오토파지, Autophagy)의 새로운 유전자 조절 메커니즘을 밝혀냈다.
박대찬 교수(생명과학과·대학원 분자과학기술학과, 사진 오른쪽)는 공동 연구팀이 포도당 결핍 상황에서 일어나는 오토파지 유전자들의 발현을 조절하는 새로운 후성유전학적 조절 메커니즘을 밝혀냈다고 발표했다. 해당 연구는 ‘인핸서 활성화를 통해 포도당 결핍 유도 오토파지의 후성유전적 조절에 핵심적 기능을 하는 PHF20(PHF20 Is Crucial for Epigenetic Control of Starvation-Induced Autophagy through Enhancer Activation)’라는 논문으로 옥스퍼드대학에서 발간하는 세계적 저널 <핵산 연구(Nucleic Acids Research)> 7월13일자에 온라인 게재됐다. 박대찬 아주대 교수(생명과학과·대학원 분자과학기술학과)와 백성희 서울대 교수(생명과학부)가 공동 교신저자로 참여했다. 제1저자로 아주대 김재훈 연구원(대학원 분자과학기술학과, 사진 왼쪽)과 서울대 박세원·오성룡 연구원(생명과학부)이 함께 참여했다.
오토파지(Autophagy)는 세포의 항상성 유지와 외부 스트레스로 인한 세포 손상을 막기 위해 필수적인 과정으로, 세포 내의 필요 없거나 손상된 단백질과 세포 소기관을 분해하는 과정을 말한다. 이 과정에서 오토파지를 일으키는 데 필요한 오토파지 단백질들도 함께 분해된다. 때문에 일정한 수준의 오토파지가 유지되기 위해서는 오토파지 유전자가 활성화되어 오토파지 단백질들을 만들고, 세포 내 오토파지 단백질의 양이 충분히 유지되어야 한다.
오토파지가 제대로 조절되지 못하면 암과 퇴행성 뇌신경 질환을 비롯한 질병이 발생하며, 노화를 촉진하기도 한다. 이에 전 세계적으로 오토파지 조절을 통해 이러한 질병들을 치료하기 위한 연구가 활발히 진행되고 있다. 그러나 포도당 결핍 같은 실제 세포 스트레스 상황에서 세포 내의 유전정보가 어떻게 오토파지 단백질의 생성으로 이어지는지에 대해서는 아직 잘 알려져 있지 않아 더 심도 깊은 연구가 필요한 분야였다.
공동 연구팀은 세포 스트레스 상황에서 PHF20 단백질(히스톤 메틸화 인지 도메인을 가지고 있는 단백질로, 다른 전사조절 인자들과 함께 특정 상황에서 유전자 발현을 조절하는 데 중요한 기능을 수행)이 오토파지 관련 유전자 발현을 증가시킨다는 점을 새롭게 밝혀내는 데 성공했다. PHF20 단백질은 다른 전사조절 인자들과 함께 특정 상황에서 유전자의 발현을 조절하는 데 중요한 기능을 수행한다.
PHF20 단백질 같은 히스톤 변형 인지 인자 히스톤 변형 인지 인자(DNA가 감긴 히스톤 단백질에 메틸화, 아세틸화 등 화학적 변형이 일어났을 때 그 구조를 인지하는 단백질)들은 최근 주목받는 생물학적 현상 중 하나인 후성유전학적 전사 조절 과정을 일으키는 핵심 인자로 알려져 있다. 후성유전학적 전사 조절이란 DNA 서열과 무관하게 유전자 발현이 조절되는 과정을 의미하며, 발생 과정이 마무리된 성체에서 나타나는 유전자 발현 변화와 관련되어 있다. 이에 암·퇴행성 질환, 노화 같은 질병과 관련해 연구되고 있지만 정확한 메커니즘에 대해서는 아직 완전히 밝혀지지 않은 부분이 많다.
연구팀은 PHF20 단백질이 결손된 실험용 쥐가 오토파지가 일어나지 못하는 돌연변이 실험용 쥐와 유사한 표현형을 나타낸다는 점에 착안, PHF20이 오토파지 유도 과정에 중요한 역할을 수행할 것이라는 가설을 세웠다. 그리고 실험을 통해 오토파지를 유도하는 세포 스트레스 중의 하나인 포도당 결핍 신호를 처리했을 때, 정상적인 오토파지의 유도가 일어나지 못한다는 점을 확인했다.
이후 연구팀은 대용량 전사체 전사체 데이터와 후성유전학적 정보를 이용해 PHF20 단백질이 조절하는 유전자군을 밝혀냈다. 또 기계학습(machine learning) 분석을 통해 해당 유전자가 위치한 크로마틴 특성을 규명했다. 그 결과 PHF20 단백질이 히스톤 메틸화된 인핸서(enhancer) 부위의 활성화를 통해 오토파지 관련 유전자들의 전사를 촉진 시키는 후성유전학적 전사 조절 메커니즘을 발굴해냈다. 오토파지 유도 신호에 의해 PHF20은 유전자상의 후성유전학적 변형을 인지하여 단백질 복합체를 이루고, 이를 통해 원거리 조절인자인 인핸서를 활성화시켜 오토파지 유전자 발현을 촉진함을 밝힌 것이다.
박대찬 교수는 “이번 연구는 오토파지 유전자 발현이 조절되는 후성유전학적 전사 조절 메커니즘을 규명, 오토파지 활성 조절의 근본적 이해를 제공했다는 데 의미가 있다”며 “오토파지 관련 질병 치료제 개발에 새로운 가능성을 제시한 셈”이라고 전했다.
박 교수는 이어 “최근 주목받는 차세대 DNA 염기서열 분석(sequencing) 기술과 기계학습을 적극적으로 도입해, 방대하고 다양한 종류의 데이터를 통합적으로 해석할 수 있었다”며 “최신 생물 정보학과 전통적 생화학적 실험 방법의 융합 사례를 보여줌으로써, 앞으로 생물학 연구에 더 폭넓게 적용할 수 있을 것으로 기대한다”고 전했다.
이번 연구는 우수신진연구자지원사업, 대학중점연구소지원사업, 리더연구자지원사업 지원으로 수행되었다.
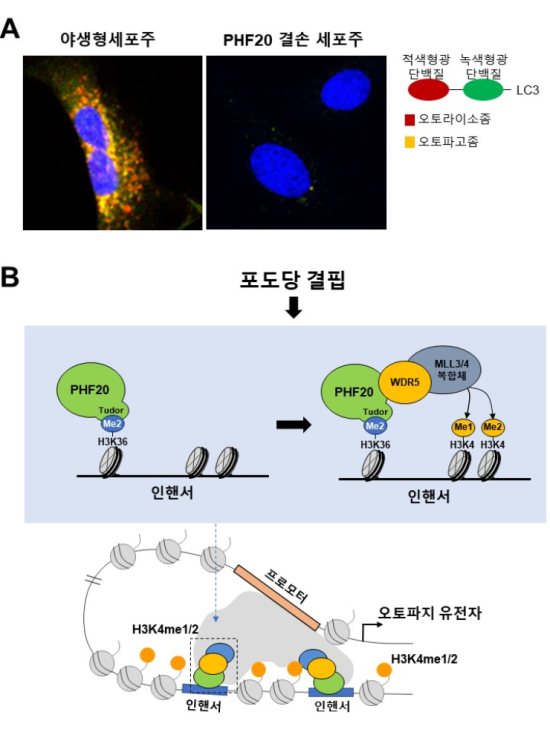
포도당 결핍에 의한 세포 자가포식(오토파지, Autophagy) 유도 과정에서 PHF20 단백질의 기능
