주요 연구성과
NEW 약대 이범진 교수팀, 암세포 치료 효능 최적화 원리 규명
- 2020-05-20
- 4453

우리 학교 약학대학 이범진 교수 연구팀이 암세포 치료 효능 최적화 원리를 규명하는데 성공했다.
관련 논문은 ‘인간 결장 직장암 이종 이식 마우스 모델에서 패티게이션 플랫폼 알부민 나노입자의 시험관내 및 생체내 항암활성에 대한 지방산 사슬 길이의 중요성(Importance of the fatty acid chain length on in vitro and in vivo anticancer activity of fattigation-platform albumin nanoparticles in human colorectal cancer xenograft mice model)’이다.
이 논문은 약학 및 약물학 분야의 저명 학술지인 <저널 오브 컨트롤드 릴리즈(Journal of Controlled Release)>에 실렸다.
연구팀의 목표는 서로 다른 사슬 길이의 지방산-접합된 알부민 나노 입자(ANP)를 설계하고 유리지방산수용체(FFAR) 과발현 세포와 HCT116 인간 결장 직장암 이종 이식 마우스 모델에서 항암 활성을 평가하는 것이었다.
지방산-알부민 접합체에서 길이가 다른 사슬 길이의 지방산(부티르산; C4 및 스테아르 산; C18)이 포접된 나노입자는 자가나노 특성과 상이한 물리 화학적 특성 및 항암 활성을 나타냈다.
특히 항암제인 독소루비신을 함유하는 장쇄지방산접합 나노입자는 HCT116 인간결장직장암 이종이식마우스 모델에서 유리지방산수용체(FFAR)와의 상호 작용을 활성화시켜, 지방산을 포접하지 않은 나노입자나 단쇄지방산 처리 그룹에 비하여 항암 활성은 개선되고 부작용은 감소함을 확인했다.
이범진 교수는 “다양한 지방산을 거대분자에 포접시키는 Fattigation platform 기술이 우리 연구진의 독창적인 분야”라며 “향후 사슬 길이가 다른 다양한 지방산을 이용하여 다양한 암치료 표적화와 난용성 약물들의 가용화 등 새로운 약물전달시스템에 활용할 수 있을 것으로 기대한다”고 전했다.
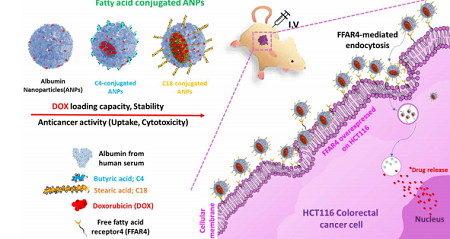
<연구팀의 암세포 치료 효능 최적화 원리를 적용해, 마우스 모델에서 항암 활성이 개선되었음을 설명하는 그림>
